RESUMO
O aumento da glicose no sangue durante a gestação é condição frequente e está relacionado a múltiplas complicações para a mãe e o bebê. Depois do primeiro trimestre da gravidez, período marcado por medida da glicose no sangue mais baixa, o crescimento da placenta promove a liberação de hormônios que favorecem o aumento da glicose na gestante susceptível. A despeito dos avanços no tratamento do diabetes, na gestação a terapia com insulina é a modalidade de escolha, considerando-se o perfil de segurança e escassez de estudos de longo prazo com outras drogas. As recomendações para o tratamento do diabetes gestacional e pré-gestacional são baseadas na opinião de especialistas e na experiência do serviço. O objetivo do estudo publicado na revista Brasília Médica é descrever a experiência do serviço de Endocrinologia e Metabologia do Hospital Universitário de Brasília no manejo de gestantes com diabetes, bem como apresentar uma abordagem prática de uso de insulina nessas pacientes.
INTRODUÇÃO
A hiperglicemia durante a gestação é condição frequente e está relacionada a numerosas complicações materno-infantis. Utilizando-se os critérios de diagnóstico atualmente propostos na literatura, estima-se que a prevalência de diabetes melito gestacional no âmbito do Sistema Único de Saúde seja de aproximadamente 18% das gestações.1 O tratamento da hiperglicemia, apesar de aumentar o número de consultas médicas no período pré-natal, promove redução dos casos de pré-eclâmpsia, distocia de ombros e macrossomia.2
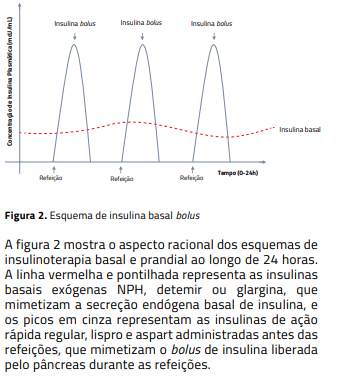
Insulinoterapia é a reposição hormonal prescrita a pessoas com diabetes melito de diversas causas, com finalidade de mimetizar a produção de insulina pelas células beta do pâncreas em condições basais e durante as refeições, a atividade física, o estresse e, ainda, durante o uso de medicamentos que aumentam a glicemia.
Para compreender os esquemas de insulinização, é preciso conhecer a fisiologia da secreção endógena de insulina e a farmacocinética das insulinas e seus análogos mais utilizados no tratamento do diabetes melito.
FISIOLOGIA DA SECREÇÃO DA INSULINA
A insulina pancreática é secretada continuamente (aproximadamente 50% do total) em condições basais, e os outros 50% são secretados em pulsos rápidos como resposta às refeições. A secreção de insulina em resposta às refeições pode alcançar até cinco vezes o valor basal, com um pico dentro de sessenta minutos.3,4 A insulina se liga a receptor de membrana heterodimérico 2 beta 2, e a porção extracelular se liga à insulina ativando o domínio tirosina-quinase da subunidade beta.5 A fosforilação da subunidade beta estimula moléculas de sinalização que interagem com outras proteínas para mediar os eventos sinalizadores da insulina. As proteínas SRIs (substratos do receptor de insulina), por exemplo, regulam a ação da PI3- quinase necessária para promover a entrada de glicose na célula por meio do transportador de glicose GLUT 4 nos tecidos sensíveis à insulina.6
USO DA INSULINA E DE SEUS ANÁLOGOS NA GESTAÇÃO
Diante da evolução do tratamento do diabetes melito, a doença do metabolismo dos carboidratos, hoje existem vastos recursos terapêuticos com drogas que apresentam diferentes mecanismos de ação a serem utilizadas conforme o tipo de diabetes e as características clínicas dos pacientes. Entretanto, durante a gestação, a insulina é considerada o medicamento de escolha e, embora existam trabalhos publicados sobre o uso da metformina e da glibenclamida na gravidez, essas drogas não são consideradas agentes de primeira linha porque atravessam a placenta e não há dados de segurança em longo prazo.7
Ao constatar a necessidade de insulinoterapia, é preciso auxiliar os pacientes a vencer a resistência psicológica ao tratamento. O estudo de Polonsky e colaboradores, realizado em indivíduos com diabetes melito do tipo 2, verificou que ensiná-los a usar a insulina, falar dos benefícios e ser acessível para esclarecer dúvidas são estratégias eficazes. Por outro lado, esse estudo identificou também que o profissional de saúde autoritário, além de não ajudar, provoca aborrecimento aos doentes e compromete o início e a manutenção do tratamento.8
Outro aspecto importante a ser abordado ao prescrever a insulina é a orientação alimentar para atingir a normalização da glicemia, o ganho de peso saudável e o crescimento fetal apropriado. A American Diabetes Association (ADA) recomenda a prescrição de plano alimentar individualizado, com base no índice de massa corporal, com a participação de nutricionista na equipe.7 Quando não houver esse profissional, o clínico deve fornecer as recomendações básicas sobre alimentação à gestante.9 As condições socioeconômicas influenciam o tratamento porque os carboidratos complexos, que devem ser priorizados devido ao menor índice glicêmico, têm custo mais elevado comparado ao dos carboidratos simples, rapidamente absorvidos pelo tubo digestivo.
A despeito dos avanços tecnológicos com relação às insulinas disponíveis, existe um descompasso entre a absorção dos carboidratos e a absorção e a ação das insulinas exógenas. Por isso, quanto mais baixo o índice glicêmico dos carboidratos, melhor será o controle metabólico e menor a variabilidade glicêmica.10,11 Se não houver contraindicação, a atividade física pode ajudar a controlar a glicemia12 e exercícios simples, como caminhada durante dez a quinze minutos após cada refeição, podem ajudar a melhorar o controle glicêmico.13
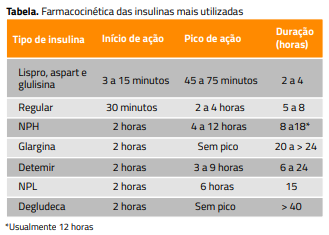
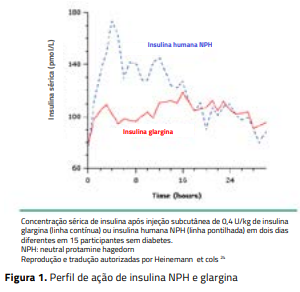
A tabela mostra a variação intra e interindividual do início, pico e duração de ação das preparações de insulina habitualmente utilizadas. Entre as insulinas prandiais, as ultrarrápidas são as mais previsíveis, comparadas à regular e não é possível prever o comportamento da insulina NPH. As ultrarrápidas iniciam a ação no período de três a quinze minutos e, por isso, é preferível usá-las no mínimo quinze minutos antes das refeições, salvo em situações especiais quando podem ser utilizadas imediatamente ou depois das refeições. A insulina regular começa a agir depois de 30 a 45 minutos da aplicação, e o pico é tardio; por isso, geralmente não controla os aumentos da glicemia de uma e duas horas depois das refeições. As insulinas NPH, detemir e glargina simulam a secreção pancreática basal de insulina,14 e a figura 1 mostra o seu perfil farmacocinético. A insulina NPH tem picos que favorecem a hipoglicemia e vales que favorecem a hiperglicemia. Seu tempo de duração costuma chegar a doze horas, mas em alguns casos atinge 18 a 24 horas. As insulinas glargina e detemir mantêm concentração mais estável se comparadas à insulina NPH, e a duração aproximada de ação destas é de 24 horas.
No Serviço de Endocrinologia e Metabologia do Hospital Universitário de Brasília, a NPH é a insulina basal mais utilizada na gravidez porque mostra maior perfil de segurança fetal, efetividade e tem baixo custo. É prescrita em dose única ao deitar para tratamento das hiperglicemias de jejum isoladas. Para tratar as hiperglicemias em vários horários do dia, fraciona-se a dose total em três aplicações diárias com o objetivo de minimizar os picos e os vales dessa insulina.
Quanto aos análogos de insulina basal, ainda não há dados suficientes para recomendá-los rotineiramente na gestação, mas seu uso pode ser mantido se for preferência das pacientes que já os utilizem antes da concepção. A insulina detemir não atravessa a placenta e é considerada categoria de risco B na gestação.15,16 A transferência placentária da insulina glargina é mínima ou ausente, e dados observacionais do uso da glargina no primeiro, segundo e terceiro trimestres não demonstraram aumento de eventos adversos à mãe e ao feto comparados ao uso da NPH.17,18
Durante a gestação, o objetivo do tratamento do diabetes melito é alcançar as metas de glicemia capilar recomendadas pela American Diabetes Association, ou seja, glicemias pré-prandiais menores que 95 mg/ dL, glicemias de uma hora após as refeições menores que 140 mg/dL ou de duas horas após as refeições, menores que 120 mg/dL.5 A despeito das metas rígidas de glicemia, a hipoglicemia grave deve ser combatida porque está associada a risco aumentado de eventos cardiovasculares e morte,19 sobretudo se o diabetes for pré-gestacional, pois é fator de risco de infarto agudo do miocárdio durante a gravidez.20 Além disso, a hipoglicemia aumenta o consumo de carboidratos, favorece a hiperglicemia rebote e o ganho excessivo de peso.
Ainda não existe consenso sobre qual o limiar de glicemias acima das metas para se iniciar a insulinoterapia. A American Diabetes Association e a American College of Obstetricians and Gynecologists (ACOG) recomendam o uso da insulina caso as glicemias capilares excedam as metas a despeito da alimentação saudável e a atividade física, mas reconhecem que essas recomendações são extrapoladas daquelas feitas para mulheres com diabetes melito pré-gestacional.7,21 Sugere-se o início da insulinoterapia quando dois ou mais valores de glicemia estão acima da meta em intervalo de duas semanas. Contudo, limiares mais altos para insulinização também são recomendados como, por exemplo, iniciar a insulina somente quando um terço das glicemias excederem o alvo em um período de sete dias.22 Considerar o perímetro abdominal fetal acima do percentil 75 no início do terceiro trimestre, também pode ser um critério para início mais precoce da terapia com insulina.23
A maioria dos estudos conclui que a necessidade diária de insulina varia de 0,7 a 2 UI/kg/dia. Entretanto, doses mais baixas desse hormônio são usadas para o tratamento de hiperglicemias mais leves. Fatores que interferem na quantidade de insulina necessária são o grau de hiperglicemia, a adiposidade, características étnicas e critérios demográficos.22 A insulinização ocorre, na maioria das vezes, em regime ambulatorial. A hospitalização estará indicada se não houver compreensão suficiente pela gestante do uso da insulina e nas hiperglicemias mais vultuosas com necessidade de esquemas de tratamento mais complexos. Nesse caso, a equipe de enfermagem tem papel fundamental em ensinar às pacientes as técnicas de aplicação de insulina.22
No Serviço de Endocrinologia do Hospital Universitário de Brasília, em um primeiro momento, protocolos mais simples de insulinização são prescritos para as gestantes com diabetes gestacional, com progressão para regimes mais complexos conforme a necessidade e a evolução da gestação.
As gestantes com hiperglicemia de jejum exclusivamente, recebem insulina NPH na dose de 0,1 UI/kg, em dose única ao deitar. As gestantes com hiperglicemias leves antes e uma ou duas horas depois das refeições iniciarão o tratamento com 0,2 a 0,4 UI/ kg/dia de NPH, e a dose total é dividida entre o café da manhã, o almoço e ao deitar.
A prescrição exclusiva das insulinas ultrarrápidas (aspart ou lispro) é destinada ao tratamento das gestantes que apresentam hiperglicemias pontuais. Como exemplo, para as hiperglicemias que ocorrem exclusivamente antes do almoço, prescreve-se insulina ultrarrápida no lanche do meio da manhã; para as hiperglicemias que ocorrem exclusivamente antes do jantar, prescreve-se insulina ultrarrápida no lanche do meio da tarde; para as hiperglicemias depois do café da manhã, o almoço e o jantar prescreve-se a ultrarrápida às respectivas refeições para evitar aumento pós-prandial da glicemia.
As pacientes com diabetes melito gestacional e hiperglicemias mais elevadas necessitam de protocolos mais complexos de tratamento e recebem prescrição inicial de insulina na dose total diária de 0,5 a 0,7 UI/kg/d. Essa dose é dividida em 50% administrada como insulina basal NPH, fracionada em três aplicações diárias, uma dose no café da manhã, no almoço e ao deitar. Os outros 50% da dose diária total são administrados como insulina ultrarrápida aplicada no mínimo quinze minutos antes do café da manhã, do almoço e do jantar. Os autores preferem os análogos de ação ultrarrápida como insulina prandial por serem mais fisiológicos. Usa-se a insulina regular 30 a 45 minutos antes do café da manhã, do almoço e do jantar quando a insulina ultrarrápida não está disponível na rede pública ou as pacientes em uso de insulina regular estão mantendo controle adequado.
O ajuste da insulina é realizado semanalmente para as gestantes em fase de compensação ou quinzenalmente para as gestantes que se encontram dentro das metas de controle glicêmico. Para as gestantes em tratamento hospitalar os ajustes são feitos diariamente. Diante de hipoglicemia, afastadas outras possibilidades, uma das causas seria a dose desproporcionalmente elevada da insulina NPH porque o longo tempo de duração pode levar à sobreposição das doses em horários inesperados. Nesse caso, reduz-se a quantidade total diária de insulina NPH e, para evitar hiperglicemia pós-prandial, introduz-se ou aumenta-se a dose ou o número de aplicações das insulinas ultrarrápidas.
Os autores orientam que as pacientes com diabetes melito pré-gestacional bem controladas apenas com a dieta, permaneçam desse modo e monitorem a glicemia. Caso passem a não atingir as metas de glicemia capilar com a evolução da gestação, é prescrita insulina usando-se o mesmo raciocínio utilizado para aquelas doentes com diabetes mellitus gestacional.
As mulheres que utilizam anti-hiperglicemiantes orais são orientadas a descontinuá-los e a iniciar insulina para atingir controle metabólico adequado. Outra possibilidade é, se bem controladas com a glibenclamida e a metformina e não for possível usar a insulina em princípio, mantenham esses hipoglicemiantes orais até quando não forem capazes de controlar a glicemia.
Na experiência dos autores, houve poucas pacientes que mantiveram a glibenclamida e a metformina na gestação por não se adaptarem à insulinoterapia domiciliar. Contudo, em nenhum dos casos, houve controle glicêmico satisfatório, e a internação hospitalar foi necessária para garanti-lo.
As mulheres com diabetes melito pré-gestacional em insulinoterapia intensiva manterão o uso das múltiplas doses diárias a serem ajustadas conforme as glicemias pré e pós-prandiais. Se o controle glicêmico não estiver adequeado, avaliar também a proporção das insulinas basal e prandial com o objetivo de mimetizar a secreção pancreática basal e prandial da isulina. Os autores preferem os análogos de ação ultrarrápida, como a insulina prandial por terem farmacocinética mais fisiológica. É usada a insulina regular 30 a 45 minutos antes do café da manhã, do almoço e do jantar quando a insulina ultrarrápida não está disponível na rede pública ou as pacientes em uso de insulina regular estão mantendo controle adequado. Como insulina basal, tem preferência a insulina NPH devido ao perfil de segurança fetal estabelecido, baixo custo e efetividade e só são prescritos os análogos detemir e glargina se for preferência da paciente quando esta já as utilizava antes da gravidez.
As gestantes tratadas com insulina são orientadas a verificar a glicemia capilar no período de duas a quatro horas da manhã se houver suspeita ou risco de hipoglicemia noturna, principalmente as doentes com diabetes melito tipo 1. Nos casos de hiperglicemia em jejum, também é necessário avaliar a glicemia pela madrugada. Se esta estiver elevada, as gestantes são orientadas a aumentar a insulina basal da noite. Se a glicemia da madrugada for normal, é provável que a hiperglicemia de jejum seja causada pelo fenômeno do alvorecer que, nas usuárias de bomba de insulina, será tratado aumentando-se a taxa de infusão nas duas a três horas que antecedem o aumento da glicemia. Nos casos em que a glicemia de madrugada estiver baixa, a hiperglicemia de jejum será explicada pelo efeito Somoghyi e orienta-se reduzir a dose de insulina basal da noite.
CONCLUSÃO
O diabetes melito gestacional é uma das complicações mais comuns da gestação. Muitas gestantes com essa condição controlam as glicemias com alimentação saudável e atividade física regular, outras necessitarão intervenção farmacológica. Já o diabetes melito pré-gestacional é uma das complicações mais desafiadoras da gravidez, com necessidade de esquemas de tratamento muito complexos para otimização do controle glicêmico. Diante da escassez dos estudos, as recomendações para o tratamento do diabetes gestacional e do pré-gestacional são baseadas na opinião de especialistas e na experiência do serviço. A automonitorização das glicemias e o contato frequente com a equipe de saúde para ajuste das medicações possibilitam maior controle metabólico para garantir a saúde da mãe e do feto.
REFERÊNCIAS
1. Trujillo J, Vigo A, Reichelt A, Duncan BB, Schmidt MI. Fasting plasma glucose to avoid a full OGTT in the diagnosis of gestational diabetes. Diabetes Res Clin Pract. 2014;105(3):322-6. DOI: 10.1016/j.diabres.2014.06.001.
2. Hartling L, Dryden DM, Guthrie A, Muise M, Vandermeer B, Donovan L. Benefits and harms of treating gestational diabetes mellitus: a systematic review and meta-analysis for the U.S. Preventive Services Task Force and the National Institutes of Health Office of Medical Applications of Research. Ann Intern Med. 2013;159(2):123-9. DOI: 10.7326/0003-4819-159-2-201307160-00661.
3. Krusynska YT, Home PD, Hanning I, Alberti KG. Basal and 24-h C-peptide and insulin secretion rate in normal man. Diabetologia. 1987;30(1):16-21.
4. Polonsky KS, Given BD, Van Cauter E. Twenty-four-hour profiles and pulsatile patterns of insulin secretion in normal and obese subjects. J Clin Invest. 1988;81(2):442-8.
5. White MF, Kahn CR. The insulin signaling system. J Biol Chem.1994;269(1):1-4.
6. Czech MP, Corvera S. Signaling mechanisms that regulate glucose transport. J Biol Chem. 1999; 274(4):1865-8.
7. American Diabetes Association. 14. Management of diabetes in pregnancy: Standards of medical care in diabetes – 2019. Diabetes Care. 2019;42(Suppl. 1):S165-S172. DOI: 10.2337/ dc19-S014.
8. Polonsky WH, Fisher L, Hessler D, Stuckey H, Snoek FJ, Tang T et al. Identifying solutions to psychological insulin resistance: An international study. J Diabetes Complications. 2019;33(4):307-14. DOI: 10.1016/j.jdiacomp.2019.01.001.
9. American College of Obstetricians and Gynecologists. Gestacional diabetes mellitus: ACOG Practice Bulletin No.190. Obstet Gynecol. 2018;131:e49-64.
10. Lennerz BS, Barton A, Bernstein RK, Dikeman RD, Diulus C, Hallberg S et al. Management of type 1 diabetes with a very low–carbohydrate diet. Pediatrics. 2018;141(6): pii: e20173349. DOI: 10.1542/peds.2017-3349.
11. Moses RG, Barker M, Winter M, Petocz P, Brand-Miller JC. Can a low-glycemic index diet reduce the need for insulin in gestational diabetes mellitus? A randomized trial. Diabetes Care. 2009;32(6):996-1000. DOI: 10.2337/dc09-0007.
12. Anjana RM, Sudha V, Lakshmipriya N, Anitha C, Unnikrishnan R, Bhavadharini B et al. Physical activity patterns and gestational diabetes outcomes – the wings project. Diabetes Res Clin Pract. 2016;116:253-62. DOI: 10.1016/j. diabres.2016.04.041.
13. Davenport MH, Mottola MF, McManus R, Gratton R. A walking intervention improves capillary glucose control in women with gestational diabetes mellitus: a pilot study. Appl Physiol Nutr Metab. 2008;33(3):511-7. DOI: 10.1139/H08-018.
14. Johansen OE, Vanberg PJ, Kilhocd BK, Jørgensen AP. Changing basal insulin from NPH to detemir or glargine in patients with type 1 diabetes and a history of severe hypoglycemia. Vasc Health Risk Manag. 2009;5(1):121-8.
15. Suffecool K, Rosenn B, Niederkofler EE, Kiernan UA, Foroutan J, Antwi K et al. Insulin detemir does not cross the human placenta. Diabetes Care. 2015;38(2):e20-1. DOI: 10.2337/ dc14-2090.
16. Mathiesen ER, Hod M, Ivanisevic M, Duran Garcia S, Brøndsted L, Jovanovic L et al. Maternal efficacy and safety outcomes in a randomized, controlled trial comparing insulin detemir with NPH insulin in 310 pregnant women with type 1 diabetes – Detemir in Pregnancy Study Group. Diabetes Care. 2012;35(10):2012-7.
17. Blum AK. Insulin use in pregnancy: An update. Diabetes Spectr. 2016;29(2):92-7. DOI: 10.2337/diaspect.29.2.92.
18. Lepercq J, Lin J, Hall GC, Wang E, Dain MP, Riddle MC et al. Meta-analysis of maternal and neonatal outcomes associated with the use of insulin glargine versus NPH insulin during pregnancy. Obstet Gynecol Int. 2012;2012:649070. DOI:10.1155/2012/649070.
19. Lo SC, Kornelius E, Huang JY, Lai YR, Huang CN, Yang YS et al. Early cardiovascular risk and all-cause mortality following an incident of severe hypoglycaemia: A population-based Cohort study. Diabetes Obes Metab. 2019; disponível em: DOI:10.1111/dom.13746
20. James AH, Jamison MG, Biswas MS, Brancazio LR, Swamy GK, Myers ER. Acute myocardial infarction in pregnancy: a United States population-based study. Circulation. 2006;113(12):1564-71.
21. Caughey AB, Kaimal AJ, Gabbe SG. American College of Obstetricians and Gynecologists. Gestacional diabetes mellitus: ACOG Practice Bulletin N. 201. Obstet Gynecol. 2018;132:e228-48.
22. Durnwald C. Gestational diabetes mellitus: Glycemic control and maternal prognosis. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. [acesso 22 maio 2019]. Disponível em: https://www.uptodate.com.
23. Bonomo M, Cetin I, Pisoni MP, Faden D, Mion E, Taricco E et al. Flexible treatment of gestational diabetes modulated on ultrasound evaluation of intrauterine growth: a controlled randomized clinical trial. Diabetes Metab. 2004;30(3):237- 44.
24. Heinemann L, Linkeschova R, Rave K, Hompesch B, Sedlak M, Heise T. Time-action profile of the long-acting insulin analog insulin glargine (HOE901) in comparison with those of NPH insulin and placebo. Diabetes Care. 2000;23(5):644-9.

Dra. Maria de Fátima de Magalhães Gonzaga
Endocrinologista, com título de especialista pela Sociedade Brasileira de Endocrinologia e Metabologia e mestrado em Ciências da Saúde pela Universidade de Brasília. Especialista em Clínica Médica, com experiência na área de Medicina Interna. Atualmente, é responsável pelo ambulatório de diabetes mellitus e pelo ambulatório de endocrinologia geral do Hospital Universitário da Universidade de Brasília. Atua como preceptora de ensino e coordenadora da Residência Médica em Endocrinologia e Metabologia na mesma instituição.